韩国KFDA---医疗器械注册
韩国的医疗器械产品注册由食品药品安全部(MFDS),前身为韩国食品药品监督管理局 (KFDA),根据《医疗器械法》进行监督。医疗器械注册格式类似于欧洲技术文件/设计档案和 510(k) 申请。值得注意的是,所有申请文件必须以韩语提交。
医疗器械定义
在韩国,单独或组合用于人类或动物的仪器、机器、设备、材料和任何类似产品均被视为医疗器械设备。
产品分类
医疗器械分类严格遵循全球协调工作组 (GHTF) 分类指南,I、II、III 和 IV 类名称从低风险到高风险分类。
注册途径(费用和周期见下图)
注册审查路线取决于设备的风险分类以及在韩国是否存在注册谓词或实质性等效 (SE)。
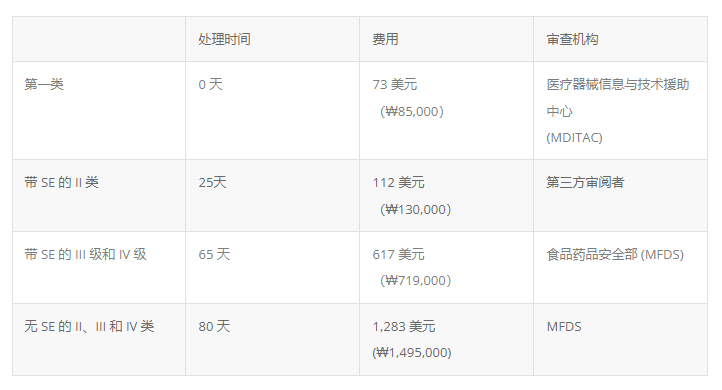
I 类设备受上市前通知 (PMN) 的约束。申请一经提交即被视为接受。通知后会发出 PMN。带有 SE 的 III 类和 IV 类也需要获得上市前批准 (PMA)。没有 SE 的 II、III 和 IV 类设备需要接受 MFDS 的安全性和有效性审查。有 6 名第三方审核员,其中 2 名是国际公司,也提供公告机构/注册服务。
设备符合性评估
除行政文件外,还需要与医疗器械质量相关的技术文件进行注册。技术文件由申请表和补充证据组成。强制提交临床试验报告(补充证据)的存在决定了申请程序。技术文档包括:预期用途、作用机制 (MoA)、操作(功能)结构、原材料、使用说明、测试规范,在某些情况下还包括临床试验数据。
质量体系合格评定
II、III 和 IV 类产品制造商需要进行质量体系符合性评估。与 ISO 1345 证明质量体系符合性的许多国家不同,韩国需要韩国良好生产规范 (KGMP) 认证,以证明质量体系符合性。
监管/合规难度
韩国以其高度复杂和高效的监管机构和流程而闻名。
有效期和续订
医疗器械注册证不会过期,但KGMP证书必须每三年更新一次。
临床试验
韩国拥有加速临床试验审批系统和 ISO 14155 合规性。目前MFDS指定的临床试验中心有166个。
韩国KFDA---IVD注册
IVD 产品注册由食品药品安全部(MFDS) 根据《医疗器械法》进行监督。在韩国注册 IVD 设备的成本和时间将因设备分类和在韩国注册的谓词设备的存在而有很大差异。韩国的分类与 GHTF 指南非常吻合。Predicacy 由基于 5 到 6 个类别的正式审查过程确定。
低风险 I 类 IVD 设备须遵守上市前通知 (PMN)。申请提交给 MFDS,并在提交后被视为被接受。签发一个 PMN 号码需要一周时间。处理申请需支付 35 美元的 MFDS 费用。
II 类 IVD 设备有两种监管途径。通过注册谓词(实质等效),产品注册申请有资格获得第三方对 IVD 设备和质量体系合格评定的审查。有 6 名第三方审核员,其中 2 名是国际公司,也提供公告机构/注册服务。第三方审核员处理申请的平均时间为 35 个工作日,平均费用为 1,500 美元。所有其他 II 类设备均需接受 MFDS 的安全性和有效性审查,处理时间为 80 天,费用为 1,000 美元。
III 类和 IV 类设备需要获得上市前批准 (PMA),申请由 MFDS 审查。实质性等效审查途径需要 65 天和 500 美元,而安全性和有效性审查途径需要 80 天和 1,000 美元。
韩国KFDA---许可证持有人
许可证持有人要求
获得许可的本地代理必须提交医疗器械注册申请并在此后持有许可。在韩国,使用独立许可证持有者还有额外的好处,因为它具有相同产品许可证注册的独特选项。MFDS 允许在当前许可证持有人的批准/证明下进行快速、相同的许可证注册。
许可证转让
由于器械许可证转让涉及接管原 KLH 所承担的所有法律责任,新 KLH 将仅在处理相同器械的重新注册以代替器械许可证转让的情况下接管 KGMP 证书。
所需文件和法律时间表如下:
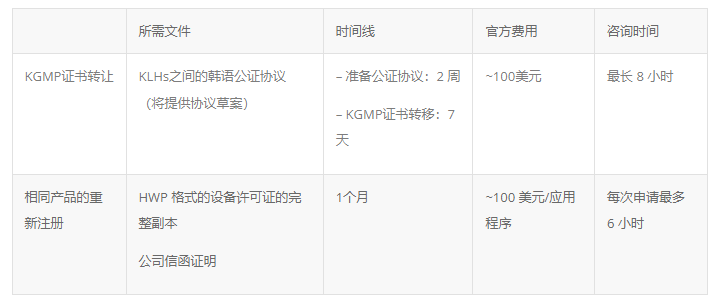
相同产品的重新注册
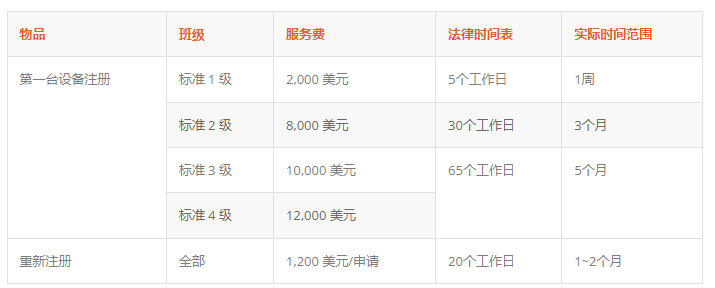
在韩国,独立许可证持有人可以重新注册相同的许可证。此选项允许许可证持有者最大化分发渠道。为了寻求重新注册途径,初始设备注册必须由 InterMD(医疗器械注册的国内代表)处理。
InterMD服务收费、时间线及示意图如下:
选择第三方持有许可证的好处
· 直接销售给多个区域分销商,避免国家进口商加价
· 提高转让定价
· 提高经销商谈判/响应中的杠杆作用
· 根据需要添加或更改分销商
· 让知识产权远离当地商业代理
· 确保专家处理上市后的警惕性和许可证维护
