



菲律宾PFDA---医疗器械注册(CMDN / CMDR)
菲律宾PFDA的医疗器械注册(CMDN/CMDR证书)由卫生部内的器械监管、辐射健康和研究中心(CDRRHR)管理。为了根据东盟医疗器械指令协调菲律宾监管指南,菲律宾卫生部最近发布了 2018-0002 号行政命令。行政令引入了医疗器械的风险分类,以及对初始器械注册和更新的新要求。
医疗器械定义
提出治疗或医疗要求的仪器、机器、体外试剂、软件和类似或相关物品在菲律宾被视为医疗器械。
产品分类
菲律宾当前的产品分类根据东盟医疗器械指令进行了协调,分为 A、B、C 和 D 四个等级,从低风险到高风险分类。新的审核时间和注册费用因风险类别而异:
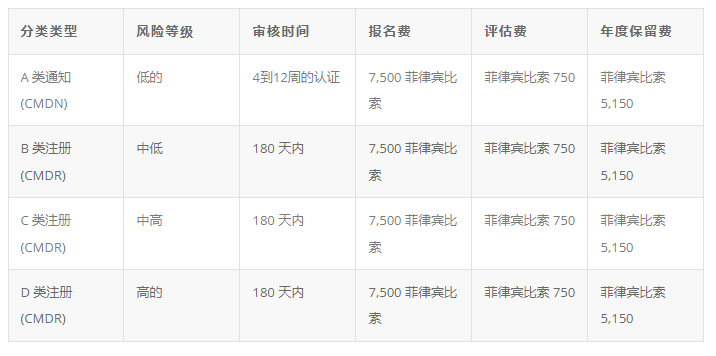
注意:IVD 不包括在此分类中。PFDA针对体外诊断设备发布单独的行政命令。
医疗设备符合性评估
2019 年 4 月 1 日实施的新法规要求风险 A 类医疗器械获得医疗器械通知证书(CMDN),风险 B、C 和 D 类医疗器械获得医疗器械注册证书(CMDR)才能获得在菲律宾进口并投放市场。新规定将分阶段实施:
1. 目前,所有 A 类医疗器械都必须具有 CMDN,并且所有已通知(在 2021-001-A 号通函中列出的)B、C 和 D 类医疗器械都必须具有 CMDR。
2. 所有未通知(未在第 2021-001-A 号通函中列出的)B、C 和 D 类医疗器械必须在 2023 年 4 月 1 日之前具备初始 CMDN,然后在更新时需要更多涉及的 CMDR。
注意:最初,非通知医疗器械的截止日期是 2022 年 4 月 1 日,但预计菲律宾 FDA 将延长宽限期。
所有类别的设备都需要本国批准或参考国家批准。
Bordeline(边缘) 产品和产品确认
如果你不确定其产品分类和/或产品类别的制造商可以向 PFDA 索取官方反馈,费用为 PHP 550。
作为审查的一部分,菲律宾PFDA 将期望看到以下文件:
1. 意向书
2. 完整的产品技术资料,必须包括以下内容:
1. 描述;
2. 以公制表示的每单位剂量相应量的配方/成分列表;
3. 适应症;
4. 使用说明;
5. 索赔(如有);和
6. 标签材料/手册。
3. 产品在原产国的分类
4. 产品目前销售的国家列表及产品在这些国家的相应分类
5. 代表性的样本
6. 付款证明 + LRF (₱ 550.00)
参考国家
除了原籍国/参考国批准之外,通知和注册还需要符合 CSDT 模板的技术文件。通知(CMDN)需要设备描述、符合性证书、符合性声明、保质期声明和清晰、完整、彩色的标签图片。注册(CMDR)需要额外的文件,例如风险评估和临床证据。
质量体系合格评定
A、B、C 和 D 类设备都需要 ISO 13485 或 FDA 或日本 PMDA 的审核报告,以证明合法和/或实际制造设施的质量体系。
监管效率
菲律宾的医疗器械注册相当简单有效。
加急审核选项
截至 2022 年 9月,菲律宾 FDA 仅对使用用于在其他东盟市场提交和批准的申请的 CSDT 文件提交的申请提供加急批准。
原产国批准要求的例外情况
严格用于研究、临床试验、展览和/或捐赠的新医疗器械免于申报和注册。使用豁免设备的研究人员和机构必须申请医疗器械上市证书。
有效期和续订
CMDN 和 CMDR 的有效期为 5 年,并且必须在初始批准后每五年更新一次。可以在 CMDR 或 CMDN 到期前 90 天提交续订。
根据旧规则颁发的产品注册证书 (CPR) 将一直有效,直至到期,届时许可证更新申请将生成一个新的 CMDN,有效期为 5 年,费用为 5,150 菲律宾比索(110 美元)。根据旧规则签发的豁免证书 (COE) 有效期至 2021 年 11 月 3 日,或签发后两年(以较短者为准)。
菲律宾PFDA--IVD注册
菲律宾体外诊断产品注册由卫生部 (DOH) 内的食品和药物管理局 (FDA) 的器械监管、放射健康和研究中心 (CDRRHR) 管理。
当前的注册要求
大多数体外诊断设备都需要产品注册证书。原产国的监管批准证明是必需的,但可以使用参考国家批准(来自美国、欧盟、加拿大、日本或澳大利亚)来代替。某些文件,如自由销售证书、ISO 证书和外国代理协议必须由菲律宾领事馆认证。获得认证可能需要 4 到 12 周,这通常是监管提交的瓶颈。PRC的初始申请需要 180 天的时间来处理。FDA 处理费总计 35 美元。初始PRC有效期为 1 年。重新注册证书的有效期为 5 年,可以在 60 到 90 天内处理,申请数据没有变化。否则,重新注册过程将需要 180 天。
不需要 CPR 的 IVD 设备必须获得豁免证书 (COE)。申请处理需要 2 到 4 周,FDA 费用为 12 美元。在发布新的监管指南之前,COE 将一直有效。
申请必须由获得许可的进口商、分销商或制造商提交,随后的 CPR 由其持有。进口商、分销商或制造商的经营许可证必须使用外国制造源数据进行更新。LTO 的修改过程需要 4 到 8 周,并需要支付 90 美元的政府费用。
质量体系合格评定必须使用 ISO 13485 或 FDA 的审核报告(例如,企业检查报告)或日本 PMDA 进行记录。
注意:2022 年 4 月更新:菲律宾 FDA 已发布体外诊断指南草案,在不久,将实施新的注册要求 ,敬请关注。
菲律宾PFDA---许可证持有人
许可证持有人要求
许可证持有人必须参与其持有进口许可证的设备的清关流程。竞争性投标第三方服务(例如货运代理)按转嫁方式收费。每个事件都会生成一份装运报告,以记录费用和文件收据。进口商、分销商或制造商的经营许可证必须使用外国制造源数据进行更新。
许可证转让
对于 CMDN/CMDR 转让项目,度外公司将要求审查现有许可证和支持性外国代理协议的副本。转让申请需提供注册证明原件。度外公司将协助从菲律宾的当前持有人处获取此文件。但是,如果当前持有人不合作,则需要进行完整的注册过程。许可证转让过程通常需要 2 到 3 个月的时间来处理。
转让所需的文件包括:
1. 请求书
2. 终止合同/转让契据
3. CMDN/CDMR(原始)
4. 完整的标签集
5. 外国代理协议
6. ISO 13485 证书
使用 第三方公司作为您的独立许可证持有者的好处
· 直接销售给多个区域分销商,避免国家进口商加价
· 提高转让定价
· 提高经销商谈判/响应中的杠杆作用
· 根据需要添加或更改分销商
· 让知识产权远离当地商业代理
· 确保专家处理上市后的警告和许可证维护

-
ECE R128 欧洲车用LED灯泡E/mark标......
2024-05-08
-
2024-05-08
-
2024-05-08
-
2024-04-08
-
2024-03-14
-
2024-03-14
-
2022-09-16
-
新加坡HSA---未注册的医疗器械如何参加新加坡展......
2022-09-16
-
2022-09-07
-
2022-09-03
-
2022-01-13
-
2022-01-07


























